به گزارش «سرویس دام، طیور و آبزیان» «ماکی دام - پایگاه خبری صنعت دام، طیور و آبزیان»؛ تشخیص بر پایه تاریخچه، علائم بالینی و نشان دادن جرم در ترشحات سقط و جنین سقط شده میباشد. بهترین نمونه برای مقاصد باکتریشناسی، تهیه یک گسترش کوتیلودونهای جفت که دارای جراحت و التهاب میباشند است.
هرچند تهیه گسترش از جفتها ارجحیت دارد لیکن میتوان از محتویات شیردان جنین سقط شده یا ترشحات واژن گوسفند تا 24 ساعت و بز تا 3 روز بعد از سقط گسترش مستقیم تهیه کرد. سوآب باید به صورت کامل به دیوارهها و کف واژن کشیده شود.
|
جدول شماره 6- نمونههای مناسب جهت تشخیص کلامیدوفیلا آبورتوس با روشهای مختلف |
|
خون |
مایعات جنین سقط شده |
سوآب واژن |
جفت |
|
|
حفره بطنی |
قفسه سینه |
شیردان |
|
- |
± |
± |
± |
± |
+++ |
باکتریشناسی |
|
|
تعیین پادگن |
|
- |
+ |
+ |
+ |
+ |
+++ |
ایمنوفلورسنس |
|
- |
+ |
+ |
+ |
+++ |
± |
الایزا |
|
- |
± |
± |
± |
+++ |
± |
PCR |
|
|
جداسازی عامل |
|
- |
+ |
+ |
+ |
+++ |
+ |
تخممرغ جنیندار |
|
- |
- |
- |
- |
+++ |
+ |
کشت سلول |
|
|
سرمشناسی |
|
+++ |
- |
- |
- |
- |
- |
CFT |
|
+++ |
- |
- |
- |
- |
- |
الایزا |
|
+++ |
- |
- |
- |
- |
- |
ایمنوفلورسنس |
+++ : نمونه بسیار مناسب
+: نمونهای که میتوان از آن استفاده کرد اما ممکن است نتیجه خوبی ندهد
± : نمونهای که استفاده از آن مشکل است
-: نمونه غیرمناسب |
تشخیص مستقیم
تشخیص با استفاده از روشهای باکتری شناسی
برخی از روشهای رنگآمیزی، جهت تشخیص کلامیدیا بهکارگرفته میشوند. این روشها سریع بوده و قابل اجرا در بیشتر آزمایشگاهها میباشند، با این وجود اغلب اوقات تفسیر نتایج حاصل از آنها دشوار است.
مهمترین مشکل این روشها، پایین بودن میزان حساسیت و ویژگی آنها است، البته مزیتی که میتوان به آن اشاره کرد این است که ماندگاری رنگ بر روی لامها خوب است، بنابراین میتوان آنها را جهت تأیید تشخیص به آزمایشگاههای مخصوص ارسال کرد.
قاعده کلی آزمایش
در گسترش تماسی تهیه شده از نمونههایی که با روشهای Machiavello، Gimenez، stamp یا گیمسا رنگآمیزی شده و توسط میکروسکوپ با درشت نمایی بالا بررسی شدهاند، کلامیدیا بهصورت ساختارهای کوکسی شکل روشن (منفرد یا گروهی) مشاهده میشود. (روشی که در این بخش بیان میشود شکل تغییر یافته روشی است که در فصل بروسلوز توضیح داده شد)
روش رنگ آمیزی استامپ
مواد و معرفها
1- میکروسکوپ، عدسی چشمی 10×، عدسی روغنی
2- محلول فوشین پایه
3- استیک اسید 0/3 %
4- مالاشیت گرین 1% در آب غیر یونیزه
روش کار
تصویر شماره 8- تشخیص بر اساس روشهای باکتریشناسی. رنگآمیزی با روش استامپ جهت تشخیص کلامیدیا.
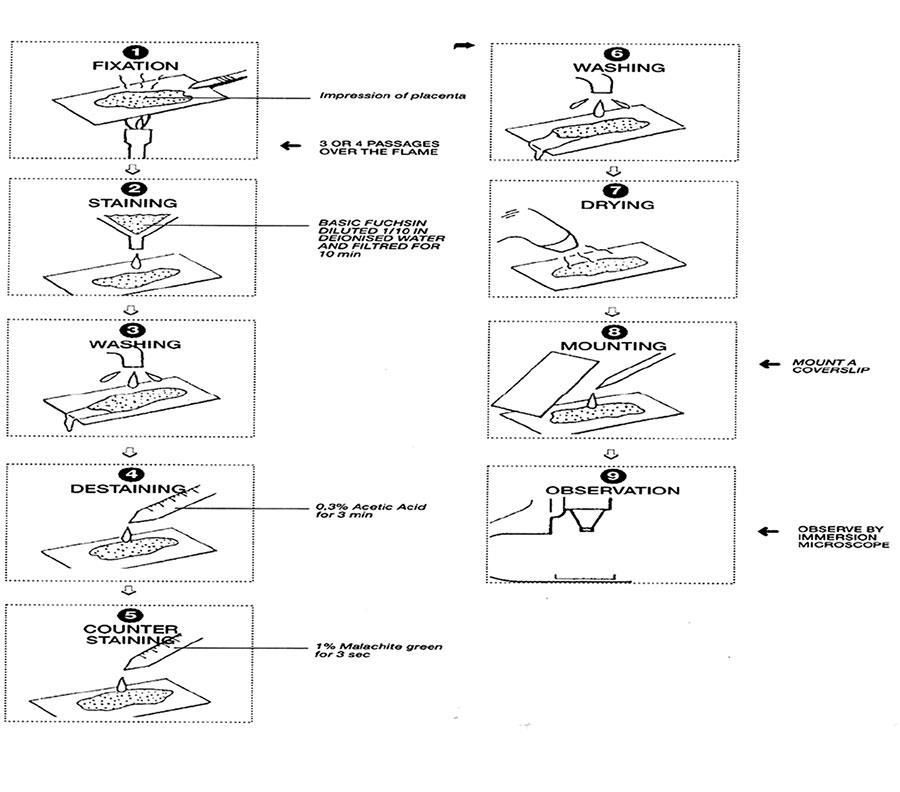
- محلول فوشین پایه
1- لام را بهوسیله شعله ثابت کنید.
2- سپس آن را به مدت 10 دقیقه در محلول فوشین پایه که با نسبت 1/10 در آب غیر یونیزه، رقیق و فیلتر شده است، قرار دهید.
3- آن را با آب بهخوبی بشویید.
4- سپس با استفاده از استیک اسید 0/3 % به مدت 30 ثانیه رنگبری را انجام دهید.
5- با محلول مالاشیت گرین برای مدت 30 ثانیه رنگآمیزی کنید.
6- آن را با آب بهخوبی بشویید.
7- لام را خشک کنید و آن را در زیر میکروسکوپ نوری مشاهده کنید.
خواندن نتایج
باکتریها به شکل اجسام قرمز روشن در زمینهای سبز آبی مشاهده میشوند.
توجه!: محلول رقیق شدهای که از فوشین پایه تهیه شده است نباید بیشتر از یک هفته نگهداری شود. بنابراین آن را بلافاصله بعد از تهیه روی لام صاف کنید، چراکه حضور رگهها یا کریستالهای کوچک رنگ، میتواند باعث ایجاد نتایج مثبت کاذب شوند.
• بسته به ضخامت نمونه، مدت زمان رنگبری با استفاده از استیک اسید و رنگآمیزی با استفاده از مالاشیت گرین میتواند متفاوت باشد.
• مشاهده نتایج با استفاده از میکروسکوپ خستهکننده، سخت و نیازمند تجربه فردی میباشد بطوریکه باید بتوان کلامیدیا را از کوکسیلا و بروسلا تفریق کرد.
• باید در کنار آزمایشهای باکتریشناسی، سایر آزمایشهای سرمشناسی نیز انجام شود تا از تفسیر اشتباه نتایج پیشگیری شود.
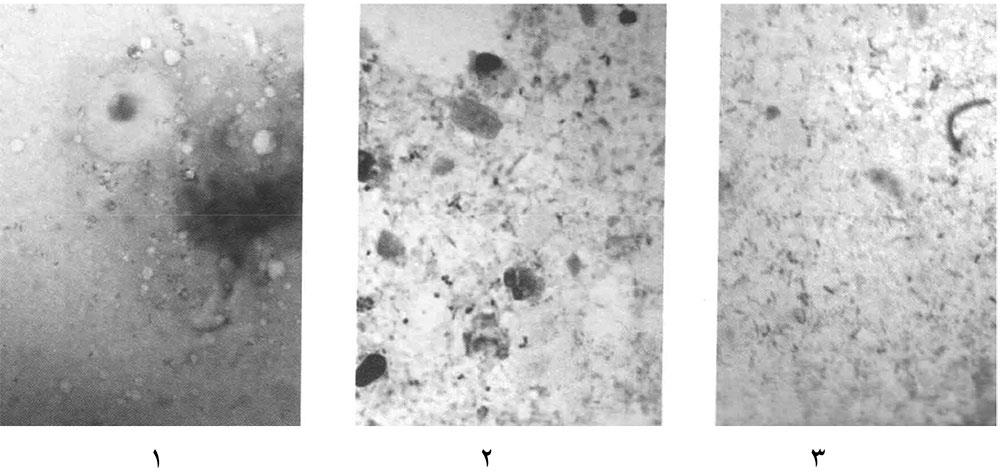
تصویر شماره 9- بررسی باکتریشناسی با کمک رنگآمیزی استامپ برای نمونههای:
1) نمونه محتویات شیردان دام مبتلا به بروسلوز
2) نمونه کوتیلودون آلوده به کلامیدوفیلا آبورتوس
3) نمونه کوتیلودون آلوده به کوکسیلا بورنتی
آماده سازی محلولها
• محلول a: اندازه 1/5 گرم از فوشین پایه را در 15 میلیلیتر اتانول 95% حل کنید. سپس آن را صاف و 24-12 ساعت صبر کنید.
• محلول b: آبی که دوبار تقطیر شده را بجوشانید، سپس 2 گرم فنول را در 50 میلیلیتر از این آب حل کنید و محلول حاصل را در محیط مرطوب سرد کنید.
• 10 میلیلیتر از محلول a را با محلول b مخلوط کنید.
• سپس محلول فوق را در داخل بالن حجمی، با استفاده از آبی که دوبار تقطیر شده به حجم 100 میلیلیتر برسانید.
• محلول حاصل را در یک ظرف دهان گشاد ذخیره کنید.