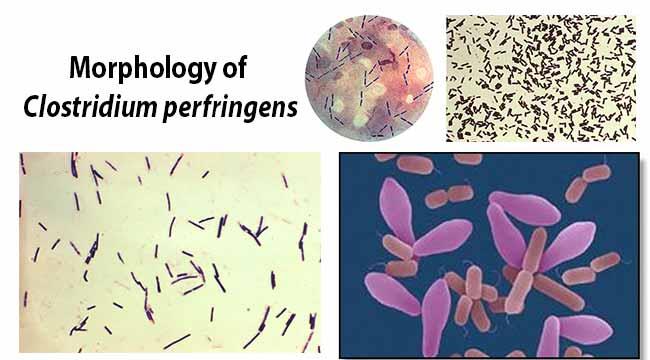
به گزارش «سرویس دام، طیور و آبزیان» «ماکی دام - پایگاه خبری صنعت دام، طیور و آبزیان»؛ هدف از این مطالعه: کلستریدیوم پرفرانژنس (clostridium perfringens) باسیل، گرم مثبت، ضخیم و کشیده، به صورت تکی یا دوتایی و به ندرت زنجیرهای است. کلستریدیوم پرفرانژنس توکسین زای تیپ A و C باعث تورم روده نکروتیک (Necrotic enteritis) در طیور گوشتی شده از طرفی سبب انترتوکسین در انسان میشود. هدف از انجام این تحقیق بررسی الگوی مقاوت داروئی کلستریدیوم پرفرانژنسهای جداسازی شده از طیورگوشتی میباشد.
روش کار: در این مطالعه پس از جداسازی 17 جدایه کلستریدیوم پرفرانژنس از گلههای گوشتی شهرستان کازرون به روشهای Summanen وهمکاران درسال 1993؛ Quinn و همکاران 1994 و miller و همکاران در سال 1998؛ آزمایش آنتیبیوگرام به روش استاندارد Kirby _ Baurer انجام یافت.
نتایج: تمامی 17 جدایه کلستریدیوم پرفرانژنس در این بررسی نسبت به پنیسیلین، ونکومایسین و کلرامفنیکل حساسیتی از 79/5درصد تا 89درصد را داشتند؛ درحالی که به ترکیبات ضدباکتریایی تتراسایکلین، لینکومایسین، نئومایسین سولفات مقاومت دارویی از 71/3درصد تا 85/8درصد را نشان دادند. همچنین مشخص گردید تمامی جدایهها به بیش از یک ترکیب ضدباکتریایی مقاومت نشان میدهند.
نتیجهگیری: با توجه به مقاومت داروئی بالای کلستریدیوم پرفرانژنسهای جداسازی شده قبل از تجویز آنتیبیوتیک انجام آزمایش آنتیبیوگرام الزامی میباشد.
بررسی الگوی مقاوت داروئی کلستریدیوم پرفرانژنسهای جداسازی شده از طیورگوشتی
بیماری آنتریت نکروتیک، یکی از بیماریهای باکتریایی در طیور میباشد. که براثر کلستریدیوم پرفرانژنس ایجاد میشود؛ کلستریدیوم پرفرانژنس باسیل، گرم مثبت، ضخیم و کشیده، به صورت تکی یا دوتایی و به ندرت زنجیرهای است.
کلستریدیوم پرفرانژنس توکسین زای تیپ A و C باعث تورم روده نکروتیک در طیور گوشتی شده، ازطرفی سبب انتروتوکسین در انسان میشود. در کشوری مانند ایران که استفاده از آنتیبیوتیکهای محرک رشد و کوکسیدیواستاتهای یونوفوره که برباکتریهای گرم مثبت اثر دارند متداول میباشد، وقوع بیماری دور از انتظار نیست. با این حال بروز بالینی این بیماری به خصوص در گلههای گوشتی بسیار محدود میباشد. در مطالعه حاضر 15 جدایه کلستریدیوم پرفرانژنس که از موارد بالینی بیماری جداسازی و خصوصیات میکروبی و بیوشیمیایی آنها مشخص گردیده بود، الگوی مقاومت دارویی آنها تعیین گردید.
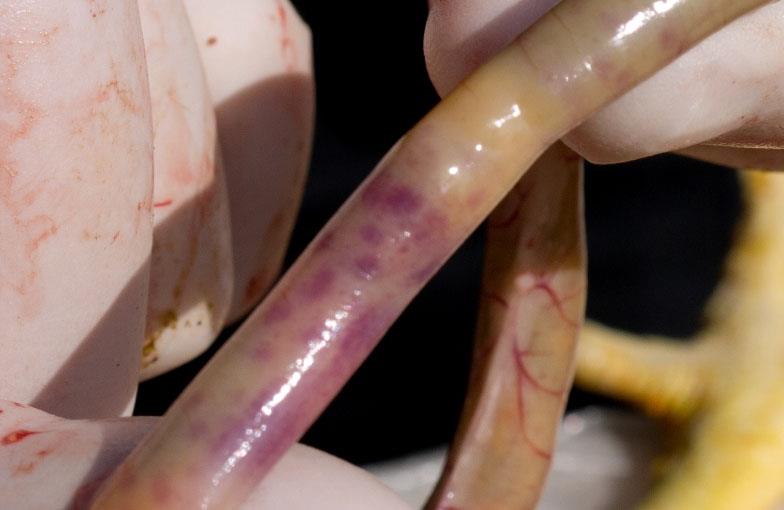
تورم روده نکروتیک
مواد وروش کار:
برای جداسازی باکتری کلستریدیوم پرفرانژنس از لاشه طیور گوشتی، ابتدا سطح سروزی روده لاشههای مبتلا توسط تیغه اسپاتول داغ استریل گردید. سپس موضع به وسیله بیستوری استریل برش داده شد و توسط یک لوپ استریل مخاط روده تخریش و پس از تهیه گسترش میکروبی و انجام رنگآمیزی گرم زیر میکروسکوپ مورد بررسی قرارگرفت شناسایی باکتری بر اساس روشهای تشریح شده توسط Summanen و همکاران در سال 1993، Quinn و همکاران 1994 و Miller و همکاران در سال 1998 صورت پذیرفت.
درصورت مشاهده باسیلهای گرم مثبت حاوی اسپور تشخیص احتمالی بر مبنای کلستریدیوم پرفرانژنس قرار میگرفت. برای جداسازی کلنیهای خالص کلستریدیوم پرفرانژنس از نمونههایی که در رنگآمیزی گرم مثبت بودند، برروی پلت آگار خوندار کشت خطی انجام شد (تمامی مراحل کشت در زیرهود آزمایشگاه و درمجاورت شعله انجام شد).
سپس پلیتهای کشت شده به صورت وارونه در داخل جار بیهوازی (Anaerobic Jar, Merck, Germany) قرارداده شدند؛ سپس گاز پک A را (Anaerobic A , Merck) در داخل جار بیهوازی قرارگرفته و پس از بستن درب جار بیهوازی حاوی پلت آگار خوندارکشت شده این جارها در انکوباتور در درجه حرارت 33 درجه سانتیگراد به مدت 20 ساعت قرار داده شدند. برای تایید شرایط بیهوازی از استریپهای اندیکاتور (Anaerotest, Merck) در هرجار استفاده شد؛ بعد از گذشت زمان فوقالذکر، درب جار بیهوازی باز شد و پلیتهای آگار کشت داده شده زیر هود، در مجاورت شعله چراغ مورد بررسی قرار گرفتند.
مشاهده کلنیهای بزرگ صاف و گرد به قطر 2تا 42میلیمتر با همولیز دوگانه (همولیز کامل در ناحیه داخلی و همولیزناقص در ناحیه بیرونی) احتمال حضور کلستریدیوم پرفرانژنس را مطرح نمود. تعدادی از این کلنیها انتخاب و پس از انجام رنگآمیزی گرم زیر میکروسکوپ مورد بررسی قرار گرفتند تا مورفولوژی مورد انتظار مشاهده شود. برای تایید تشخیص ازمحیطهای متعددی استفاده شد. نمونهها احتمالاً مثبت به صورت خطی بر روی پلیتهای آگار زرده تخممرغ (Merck) کشت داده شدند.
پلیتهای آگار زرده تخممرغ کشت شده به مدت 48 ساعت تحت شرایط بیهوازی در 37 درجه سانتیگراد انکوبه گردیدند. باکتریهای کلستریدیوم پرفرانژنس لسیتیناز تولید میکنند که به صورت وجود کدورت و سفیدی در محیط اطراف کلنی باکتری که دلیل بر فعالیت لیستیناز باکتری است، مشخص میشود.
آزمایش بعدی، تست برای عدم تولید لیپاز بود که بر روی محیط کشت آگار زرده تخممرغ صورت گرفت. از آنجایی که این باکتری لیپاز تولید نمیکند درمحیط آگار زرده تخممرغ واکنش مربوط به لیپاز یعنی تولید هاله در اطراف کلنی باکتری کلستریدیوم پرفرانژنس به وجود نمیآید.
آزمایش دیگری که برروی نمونهها انجام شد آزماش کمپ – معکوس (Reverse-CAMP test) بود. باکتری کلستریدیوم پرفرانژنس تیپ A و باکتری استرپتوکوکوس آگالاکتیه بتا همولیتیک با یکدیگر الگوی سنیرژیستیک همولایتیک کمانی شکل تیپیک روی آگار خوندار ایجاد میکنند.
برای لاین منظور ابتدا باکتری کلستریدیوم پرفرانژنس احتمالی را به صورت یک خط روی محیط آگار خوندار کشت داده و سپس استرپتوکوکوس آگالاکتیه بتا همولیتیک به صورت خط عمود بر خط کشت نمونه مشکوک کشت داده شد، به نحوی که باهم تلاقی نداشته باشند (با چند میلیمتر فاصله). پلیتها به مدت 24 تا 48 ساعت آنکوبه شدند. در موارد مثبت همولیزهای کمانی شکل مشاهده شدند.
آزمایش بعدی، آزمایش اوره آز بود. برای این منظور محیط استریل اوره تهیه شده و نمونهها در آن کشت داده شدند و در شرایط بیهوازی و در دمای 37 درجه سانتیگراد به مدت 48 ساعت آنکوبه گردیدند. کلستریدیوم پرفرانژنس اوره آز منفی بوده لذا تغییر رنگ ایجاد نمیشود. آزمایش حرکت نیز درمورد نمونهها انجام شد. برای این منظور باکتری در لولههای حاوی محیط اوره کشت شد در صورت بروز کدورت و تولید گاز CO2 باکتری محرک تلقی گردید. لازم به ذکراست که باکتری کلستریدیوم پرفرانژنس فاقد حرکت میباشد.
در ادمه تست ایندول بر روی نمونهها نیز انجام شد. باکتری کلستریدیوم پرفرانژنس ایندول تولید نمینماید. برای تایید نهایی، نمونههای به دست آمده که در آزمایشات قبلی مثبت بودند (ازنظر کلستریدیوم پرفرانژنس) برروی محیط (TSN (Tryptone Sulfite Neomycin agar آگار (Merck) که محیط اختصاصی کلستریدیوم پرفرانژنس میباشد کشت داده شدند.
پلیتهای کشت داده شده در شرایط بیهوازی به مدت 18 ساعت در 37 درجه سانتیگراد انکوبه گردیدند. بعد از طی مدت زمان مذکور درصورت وجود نتیجه مثبت کلنیهایی با هسته مرکزی تیره رنگ مشاهده شدند که بیانگر حضور باکتری کلستریدیوم پرفرانژنس بود.
تعیین الگوی مقاومت دارویی جدایهها:
برای تعیین حساسیت 17 جدایه کلستریدیوم پرفرانژنس نسبت به داروهای ضد باکتریایی از آزمایش دیسک دیفوزیون به روش استاندارد (Kirby-Bauer) استفاده شد. محیط کشت انتخابی در این روش (Merck Mueller – Hinton) است که رشد پرگنهها را به صورت انفرادی و در کنار هم به طور رضایتبخشی فراهم میکند. شش عامل ضد باکتریایی مورد آزمایش و غلظت بالقوه آنها (برحسب میکروگرم) عبارت بودند از: پنیسیلین، ونکومایسین، لینکومایسین، کلرامفنیکل، تتراسایکلین و نئومایسین که همگی از شرکت پادتن طب (ایران) تهیه شده است.
آزمایش برای هر 17 جدایه به شرح زیر انجام شد:
کلستریدیوم پرفرانژنس برداشت شده از محیط ذخیره Brain Heart infusion Broth) BHB) (آبگوشت مغز و قلب) روی محیط آگار خوندار کشت خطی داده شده و به مدت 24 ساعت در 37 درجه سانتیگراد در شرایط بیهوازی آنکوبه گردید. سپس 4تا 5 کلنی تک کلستریدیوم پرفرانژنس از محیط آگار خوندار برداشت شده و به یک لوله آزمایش دربدار حاوی 4تا 5 سانتیمتر مکعب محیط BHB انتقال داده شد.
محیط تلقیح شده به مدت 2 تا 8 ساعت در دمای 37 درجه سانتیگراد و شرایط بیهوازی تا مشاهده یک کدورت واضح و قابل قبول با کدورت استاندارد 0/5 مک فارلند انکوبه گردید. سپس یک سواپ استریل به درون این سوسپانسیون باکتریایی وارد و مایع اضافی سواپ با فشار و چرخاندن به جداره داخلی لوله حاوی سوسپانسیون باکتریایی گرفته شد؛ سواپ به صورت خطی و بدون فاصله بین خطوط کشت برروی سطح محیط مولرهینتون آگار (ضخامت محیط کشت فوق 2 میلیمتر بود) که 20 دقیقه قبل از استفاده از یخچال خارج گردیده بود، کشت داده شد. به منظور تلقیح یکنواخت، کشت خطی سه مرتبه انجام شد. بدین نحو که هر مرتبه پلیت حاوی محیط کشت به میزان 62 درجه نسبت به دفعه قبل چرخانده شده و مجدداً سواپ بر روی آن به صورت خطی کشیده شد.
در نهایت سر سواپ به لبه خلفی پلیت و در تماس با سطح محیط کشت چسبانده و یک دور کامل چرخانده شد. پلیتهای تلقیح شده به مدت 3تا 5 دقیقه به همان حال باقی ماندند تا رطوبت اضافی قبل ازگذاشتن دیسکهای آنتیبیوگرام توسط آگار جذب شود؛ سپس دیسکهای مورد آزمایش که 1ساعت قبل، به منظور رسیدن به درجه حرارت آزمایشگاه از یخچال خارج شده بودند توسط پنس استریل بر روی سطح محیط مولرهینتون آگار تلقیح شده قرارداده شدند.
به منظور رعایت فاصله بین دیسکها بر روی محیط کشت به میزان 24 میلیمتر از یکدیگر و 15 میلیمتر از جدار پلیت فقط 6 دیسک بر روی یک پلیت 90 میلیمتری گذاشته شد. ظرف مدت 15 دقیقه پس از دیسک گذاری، پلیتهای جمعآوری شده و در وضعیت وارونه به مدت 16 تا 18 ساعت در 37 درجه سانتیگراد و در شرایط بیهوازی آنکوبه شدند؛ بعد از این مدت برای قرائت نتیجه آزمایش با استفاده از چشم غیرمسلح و در حضور نور متمرکز، قطرهاله ممانعت از رشد هر ضد باکتریای بر حسب میلیمتر توسط کولیس اندازهگیری شد و با جدول تفسیر قطر هاله ممانعت براساس حساس و مقاوم طبقهبندی شدند.
نتایج:
تمامی 17 جدایه کلستریدیوم پرفرانژنس در این بررسی نسبت به پنیسیلین، ونکومایسین و کلرامفنیکل حساسیتی از 79/5درصد تا 89درصد را داشتند؛ درحالی که به ترکیبات ضدباکتریایی تتراسایکلین، لینکومایسین، نئومایسین سولفات مقاومت دارویی از 71/3درصد تا 85/8درصد را نشان دادند. همچنین مشخص گردید تمامی جدایهها به بیش از یک ترکیب ضدباکتریایی مقاومت نشان میدهند (جدول 1).
همچنین مشخص شد که 100درصد جدایههای کلستریدیوم پرفرانژنس به بیش از یک ترکیب ضد باکتریایی مقاومت نشان دادند (جدول 2)
جدول شماره یک(1): درصد مقاومت دارویی 15 جدایه کلستریدیوم پرفرانژنس از مرغ گوشتی نسبت به 6 ترکیب ضدباکتریایی
|
ترکیبات ضدباکتریایی |
%جدایه های مقاوم |
% جدایه های نیمه حساس |
%جدایه های حساس |
|
پنیسیلین |
20/5 |
0 |
79/5 |
|
ونکومایسین |
10 |
1 |
89 |
|
لینکومایسین |
71/3 |
4 |
24/7 |
|
کلرامفنیکل |
0 |
18 |
82 |
|
نئومایسین سولفات |
85 |
6 |
9 |
|
تتراسایکلین |
81 |
10 |
9 |
بحث:
بیماری ورم روده نکروتیک به وسیله تکثیر باکتری کلستریدیوم پرفرانژنس تیپ A و C در روده کوچک ماکیان ایجاد میشود از طرفی دو تیپ مذکور در انسان سبب انتروتوکسین میشوند. که این یک مشکل رایج در ماکیان بوده و به عنوان یک بیماری زئونوز مطرح میباشد. لازم به ذکر است که از میان 1709 عامل بیماریزا 832 عامل زئونوز میباشد.
ورم روده نکروتیک در اروپا، آسیا و آمریکای شمالی در حال تبدیل شدن به یک بیماری عمومی است. در سال 1995، بیماری ورم روده نکروتیک 4درصد از بیماریهای گزارش شده در فرانسه را شامل میشود که در سال 1999 این رقم به 12/4درصد افزایش یافت.
Devriese و همکاران طی سالهای 1991 و 1992 حداقل غلظت مها ری 7 آنتیبیوتیک محرک رشد علیه 95 جدایه کلستریدیوم پرفرانژنس حاصل از طیور، خوک و گوساله را مورد ارزیابی قراردادند. همه این سویهها به آنتیبیوتیکهای بامبرمایسین، فلاوومایسین (فلاووفسفولیپول) مقاومت نشان دادهاند ولی به آووپارسین، آویلامایسین و سالینومایسین حساس بودند.
مقاومت به تایلوزین و ویرجینیامایسین در بعضی جدارههای حاصل ازتمام گونهها بررسی شده، شناسایی گردید. دربررسی که توسط Tansuphasiriu و همکاران در سال 2005 روی 201 جدایه کلستریدیوم پرفرانژنس جداشده از مدفوع انسان، خوک و غذا و سایر منابع محیطی (که به وسیله PCR تایید شده بود) نسبت به 7 ترکیب ضدباکتریایی انجام شد، مشخص گردید که بیشترین مقاومت این جدایهها به ترتیب در برابر تتراساکلین (56/2درصد)، ایمیپنوم (24/9درصد)، مترونیدازول (9/5درصد)، پنیسیلینG (حدود 9درصد) و ونکومایسین (4/5درصد)، کلرامفنیکل (3درصد) و سفتراکسون (1درصد) میباشد.
در مطالعه حاضر طیف و میزان مقاومت جدایهها به ترکیبات ضدباکتریایی گسترده و بالا بود به طوری که جدایای کلستریدیوم پرفرانژنس مورد بررسی بیشترین مقاومت را نسبت به 3 ترکیب ضدباکتریایی نئومایسین سولفات با 85درصد تتراسایکیلین با 81درصد و لینکومایسین با 71درصد نشان دادند. همچنین کمترین مقاومت جدایای کلستریدیوم پرفرانژنس نسبت به کلرامفنیکل با صفر درصد، ونکوماییسین با 9/8درصد و پنی سیلین با 18/7درصد بود. Martel وهمکاران در سال 2002 در بررسی خود حساسیت جدایههای کلستریدیوم پرفرانژنس که از روده طیور گوشتی از 31 مزرعه مختلف طیور گوشتی در بلژیک جدا شده بودند را نسبت به 12 ترکیب آنتیبیوتیک که برای درمان، تحریک رشد یا پیشگری از کوکسیدیوز به کار میرفت، ارزیابی نمود و نشان دادند که جدایهها به طور یکسانی به آنتیبیوتیکهای یونوفوره از قبیل موننسین، لازولاسید، سالینومایسین، مادورامایسین و ناراسین حساس بودند.
جدول شماره دو(2): مقاومت چندگانه جدایههای کلستریدیوم پرفرانژنس از مرغ گوشتی نسبت به ترکیبات ضدباکتریایی از مجموع 6 ترکیب
|
درصد جدایههای مقاوم |
تعداد ترکیبات ضد باکتریایی |
|
100 |
1 |
|
100 |
>1 |
|
95 |
>2 |
در این مطالعه نیز درصد بالایی از مقاومت نسبت به بعضی از آنتیبیوتیکها مانند: تتراسایکلین، لینکومایسین و نئومایسین و سولفات دیده شد. با این حال Johansson وهمکاران دریافتند که مقاومت به تتراسایکلین در سویههای جدا شده از 3 کشور سوئد با 76درصد، دانمارک با 10درصد و نروژ با 29درصد و در 80درصد جدایههای مقاوم به تتراسایکلین (با روش PCR) تعداد 2 ژن مقاومت (tetA(p) tetB(p شناسایی گردید و تنها در 20درصد جدایههای مقاوم به تتراسایکلین ژن(tetA(p ، وجود داشت. این درجات مقاومت به تتراسایکلین در جدایههای کلستریدیوم پرفرانژنس طیورگوشتی درسوئد درحالی بود که میزان مصرف تتراسایکلین در طیور این کشور در کمترین مقداربود. با توجه به مقاومت داروئی بالای کلستریدیوم پرفرانژنسهای جداسازی شده قبل از تجویز آنتیبیوتیک انجام آزمایش آنتیبیوگرام الزامی میباشد.
منبع: هفدهمین کنگره دامپزشکی ایران (اردیبهشت 1391)
علی قربانی رنجبری: دانشجوی دکترای دامپزشکی دانشگاه آزاداسلامیکازرون- ایران (عضو باشگاه پژوهشگران جوان دانشگاه آزاد اسلامی واحد کازرون)
رضا صدری پور: دانشجوی دکترای دامپزشکی دانشگاه آزاداسلامیکازرون- ایران
زهراقربانی رنجبری و نازنین قربانی رنجبری: دانشجوی شیلات دانشگاه علوم وفنون دریایی خرمشهر